W poniższym opracowaniu przedstawię Państwu dwa bardzo ładne eksperymenty. Połączyłem je ze sobą bo produkt z pierwszej reakcji zostanie wykorzystany do przeprowadzenia drugiego eksperymentu. Eksperymenty te miałem okazję pierwszy raz zobaczyć podczas pokazów na Wydziale Chemii Politechniki Warszawskiej w czasie Festiwalu Nauki dawno, dawno temu. Pamiętam jednak, że zrobiły na mnie piorunujące wrażenie, pewnie dlatego też, że były prowadzone w naprawdę makro skali :)

 Podczas wykonywania prezentowanego eksperymentu należy stosować ochronę twarzy !!!
Podczas wykonywania prezentowanego eksperymentu należy stosować ochronę twarzy !!!
Stosowane podczas prowadzenia eksperymentu odczynniki są szkodliwe dla zdrowia, należy stosować rękawice ochronne, a eksperyment prowadzić w dobrze wentylowanym pomieszczeniu lub pod wyciągiem.
Niestety nie mam możliwości wykonać eksperymentu w tak dużej skali, ale myślę, że i tak udało się zrobić kilka ładnych zdjęć, które oddadzą jego piękno. Zaczniemy od potrzebnych odczynników i sprzętu, potrzebne nam będą: Dwuchromian Amonu (NH4)2Cr2O7 oraz wodny roztwór amoniaku NH4OH, tzw. woda amoniakalna.

Rys. 1 Sprzęt i odczynniki niezbędne do przeprowadzenia eksperymentu.
Jak widać na powyższym zdjęciu oprócz odczynników przyda się także trochę sprzętu, będzie to palnik Bunsena, duża kolba kulista, moja ma 2 litry, tygiel, parownica, szczypce, gwóźdź oraz łyżeczka do spalań. Przy tej łyżeczce zatrzymamy się nieco dłużej bo dla jeszcze lepszego efektu drugiej części doświadczenia musimy ją nieco wzbogacić.
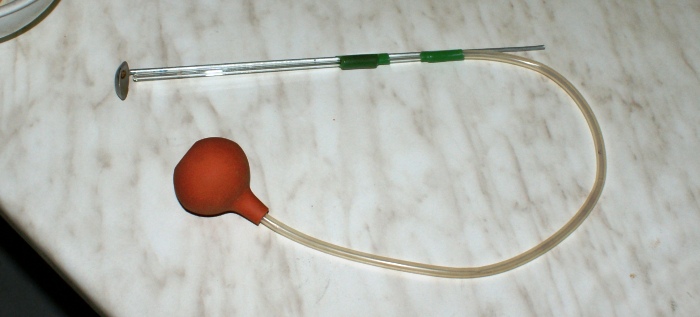
Rys. 2 Łyżeczka do spalań z dmuchawką.
W eksperymencie trzeba będzie wprowadzić substancję do kolby i szybko zdmuchnąć ją z łyżeczki, można to zrobić potrząsając nią, ale znacznie lepiej będzie zastosować dmuchawkę. Zrobiłem to w ten sposób, że do łyżeczki przymocowałem na stałe cienką rurkę szklaną połączoną z wężykiem i gruszką.

Rys. 3 Dwuchromian amonu.
Zanim jednak prezentowaną wyżej łyżeczkę zastosujemy, zajmiemy się pierwszą częścią eksperymentu. Będzie to termiczny rozkład dwuchromianu amonu, reakcja bardzo często wykonywana podczas pikników naukowych, gdzie tłumy ludzi zasypywane są ciemnozielonkawym tlenkiem chromu. Można to zobaczyć na mojej stronie w dziale: imprezy naukowe.

Rys. 4 Przygotowania do rozpoczęcia reakcji rozkładu.
Nie mam ochoty zasypać pracowni kilogramem tlenku :) więc zastosuję znacznie mniej odczynnika. Eksperyment ten najlepiej jest wykonać w aranżacji wulkanicznej, tzn. wykonać np. z gliny model wulkanu z kraterem, gdzie można wprowadzić dwuchromian.
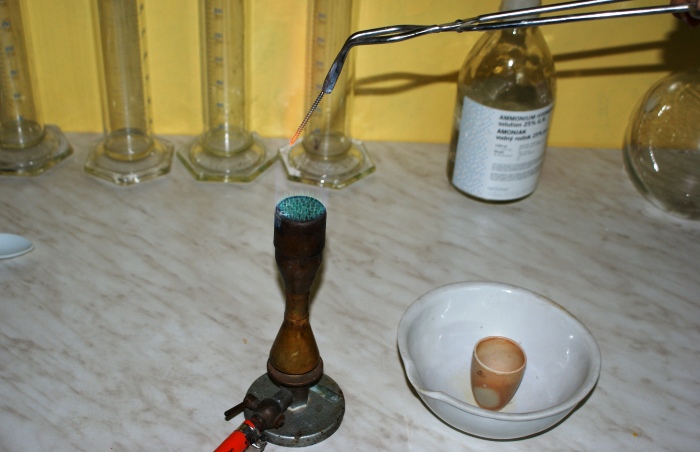
Rys. 5 Rozgrzewanie gwoździa w płomieniu palnika.
Rozkładająca się substancja wspaniale imituje erupcję wulkanu, mamy mnóstwo popiołu, efekty świetlne, dźwiękowe no i iskry. Nie miałem pod ręką materiału na uformowanie krateru więc zastosowałem tygiel wraz z parownicą, by nie zbierać tlenku z blatu stołu.

Rys. 6 Inicjowanie rozkładu substancji rozgrzanym gwoździem.
Dwuchromian amonu jest substancją wrażliwą na podwyższoną temperaturę, po zetknięciu z rozgrzanym do czerwoności gwoździem zaczyna się rozkładać z wydzieleniem dużej ilości puszystego tlenku chromu oraz produktów gazowych zgodnie z równaniem reakcji:
(NH4)2Cr2O7 --> Cr2O3 + N2 + 4H2O
Tlenek wyrzucany jest w powietrze przez powstający azot i parę wodną do złudzenia przypominając aktywny wulkan.

Rys. 7 Erupcja chemicznego wulkanu - rozkład dwuchromianu amonu.






