W poniższym opracowaniu przedstawię Państwu dwa bardzo ładne eksperymenty. Połączyłem je ze sobą bo produkt z pierwszej reakcji zostanie wykorzystany do przeprowadzenia drugiego eksperymentu. Eksperymenty te miałem okazję pierwszy raz zobaczyć podczas pokazów na Wydziale Chemii Politechniki Warszawskiej w czasie Festiwalu Nauki dawno, dawno temu. Pamiętam jednak, że zrobiły na mnie piorunujące wrażenie, pewnie dlatego też, że były prowadzone w naprawdę makro skali :)

 Podczas wykonywania prezentowanego eksperymentu należy stosować ochronę twarzy !!!
Podczas wykonywania prezentowanego eksperymentu należy stosować ochronę twarzy !!!
Stosowane podczas prowadzenia eksperymentu odczynniki są szkodliwe dla zdrowia, należy stosować rękawice ochronne, a eksperyment prowadzić w dobrze wentylowanym pomieszczeniu lub pod wyciągiem.
Niestety nie mam możliwości wykonać eksperymentu w tak dużej skali, ale myślę, że i tak udało się zrobić kilka ładnych zdjęć, które oddadzą jego piękno. Zaczniemy od potrzebnych odczynników i sprzętu, potrzebne nam będą: Dwuchromian Amonu (NH4)2Cr2O7 oraz wodny roztwór amoniaku NH4OH, tzw. woda amoniakalna.

Rys. 1 Sprzęt i odczynniki niezbędne do przeprowadzenia eksperymentu.
Jak widać na powyższym zdjęciu oprócz odczynników przyda się także trochę sprzętu, będzie to palnik Bunsena, duża kolba kulista, moja ma 2 litry, tygiel, parownica, szczypce, gwóźdź oraz łyżeczka do spalań. Przy tej łyżeczce zatrzymamy się nieco dłużej bo dla jeszcze lepszego efektu drugiej części doświadczenia musimy ją nieco wzbogacić.
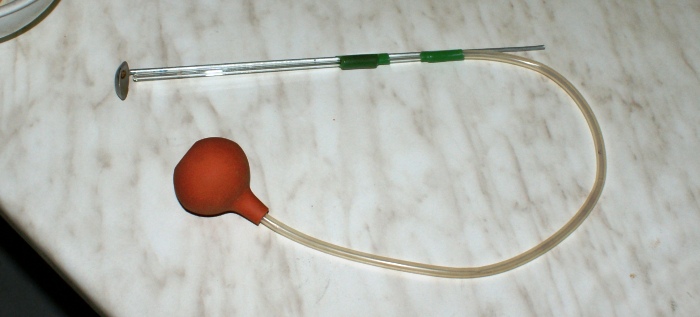
Rys. 2 Łyżeczka do spalań z dmuchawką.
W eksperymencie trzeba będzie wprowadzić substancję do kolby i szybko zdmuchnąć ją z łyżeczki, można to zrobić potrząsając nią, ale znacznie lepiej będzie zastosować dmuchawkę. Zrobiłem to w ten sposób, że do łyżeczki przymocowałem na stałe cienką rurkę szklaną połączoną z wężykiem i gruszką.

Rys. 3 Dwuchromian amonu.
Zanim jednak prezentowaną wyżej łyżeczkę zastosujemy, zajmiemy się pierwszą częścią eksperymentu. Będzie to termiczny rozkład dwuchromianu amonu, reakcja bardzo często wykonywana podczas pikników naukowych, gdzie tłumy ludzi zasypywane są ciemnozielonkawym tlenkiem chromu. Można to zobaczyć na mojej stronie w dziale: imprezy naukowe.

Rys. 4 Przygotowania do rozpoczęcia reakcji rozkładu.
Nie mam ochoty zasypać pracowni kilogramem tlenku :) więc zastosuję znacznie mniej odczynnika. Eksperyment ten najlepiej jest wykonać w aranżacji wulkanicznej, tzn. wykonać np. z gliny model wulkanu z kraterem, gdzie można wprowadzić dwuchromian.
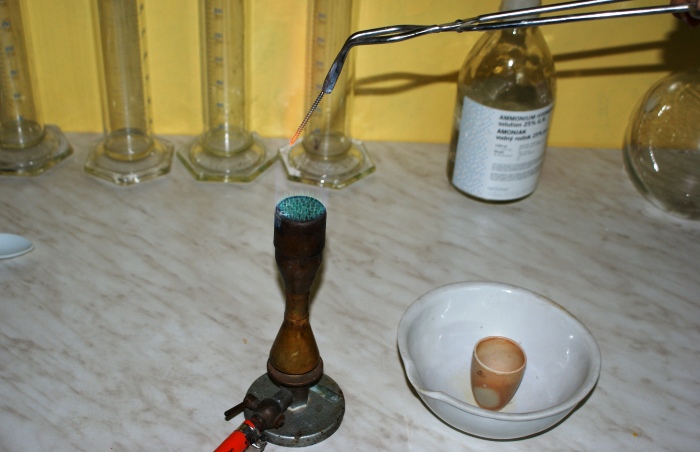
Rys. 5 Rozgrzewanie gwoździa w płomieniu palnika.
Rozkładająca się substancja wspaniale imituje erupcję wulkanu, mamy mnóstwo popiołu, efekty świetlne, dźwiękowe no i iskry. Nie miałem pod ręką materiału na uformowanie krateru więc zastosowałem tygiel wraz z parownicą, by nie zbierać tlenku z blatu stołu.

Rys. 6 Inicjowanie rozkładu substancji rozgrzanym gwoździem.
Dwuchromian amonu jest substancją wrażliwą na podwyższoną temperaturę, po zetknięciu z rozgrzanym do czerwoności gwoździem zaczyna się rozkładać z wydzieleniem dużej ilości puszystego tlenku chromu oraz produktów gazowych zgodnie z równaniem reakcji:
(NH4)2Cr2O7 --> Cr2O3 + N2 + 4H2O
Tlenek wyrzucany jest w powietrze przez powstający azot i parę wodną do złudzenia przypominając aktywny wulkan.

Rys. 7 Erupcja chemicznego wulkanu - rozkład dwuchromianu amonu.

Rys. 8 Erupcja chemicznego wulkanu - rozkład dwuchromianu amonu.
 Rys. 9 Erupcja chemicznego wulkanu - rozkład dwuchromianu amonu.
Rys. 9 Erupcja chemicznego wulkanu - rozkład dwuchromianu amonu.

Rys. 10 Erupcja chemicznego wulkanu - rozkład dwuchromianu amonu.

Rys. 11 Erupcja chemicznego wulkanu - rozkład dwuchromianu amonu.

Rys. 12 Erupcja chemicznego wulkanu - rozkład dwuchromianu amonu.
Po zakończeniu efektownej erupcji mamy już materiał do przeprowadzenia części drugiej eksperymentu, która na pewno będzie dużo bardziej efektowna. Będzie to katalityczne utlenianie amoniaku. Popiół, który wyprodukowaliśmy to tlenek chromu, który po podgrzaniu do wysokiej temperatury spełni rolę katalizatora reakcji. Najpierw należy dokładnie umyć kolbę by ścianki nie były zabrudzone, co sprawi że efekt będzie lepiej widoczny. Następnie do środka wprowadzamy kilka ml wody amoniakalnej i podgrzewamy delikatnie nad płomieniem palnika by kolba wypełniła się gazowym amoniakiem.

Rys. 13 Podgrzewanie tlenku na przygotowanej łyżeczce do spalań.
Podczas wypełniania kolby amoniakiem dobrze jest użyć gumowego korka i delikatnie zamknąć wylot kolby pamiętając, że wydziela się gaz u musi mieć gdzie się wydostać. Korek zapobiegnie ponownemu wpływowi powietrza do środka. Teraz na łyżeczkę do spalań nabieramy odrobinę tlenku chromu, rozgrzewamy do białości w płomieniu palnika i wprowadzamy do kolby. Okazuje się że tlenek nie stygnie, wręcz przeciwnie rozgrzewa się jeszcze bardziej. Na jego powierzchni następują reakcje chemiczne utleniania. W kolbie był gazowy amoniak i tlen z powietrza, zachodzące reakcje mogą mieć postać:
2NH3 + 2O2 --> N2O + 3H2O
4NH3 + 3O2 --> 2N2 + 6H2O
W reakcji powstaje głównie azot, trochę podtlenku azotu i woda, jednak w zależności od temperatury proporcji gazów mogą także powstawać inne tlenki azotu. Podczas jednej z prób dało się wyczuć charakterystyczny zapach dwutlenku azotu.
Jednak nie przeprowadziliśmy tej reakcji by otrzymać jakiś tam azot, miało być przecież efektownie !. I będzie jeśli na taką łyżeczkę z żarzącym się tlenkiem w mieszaninie amoniaku i powietrza dmuchniemy i rozsypiemy go po całej kolbie.
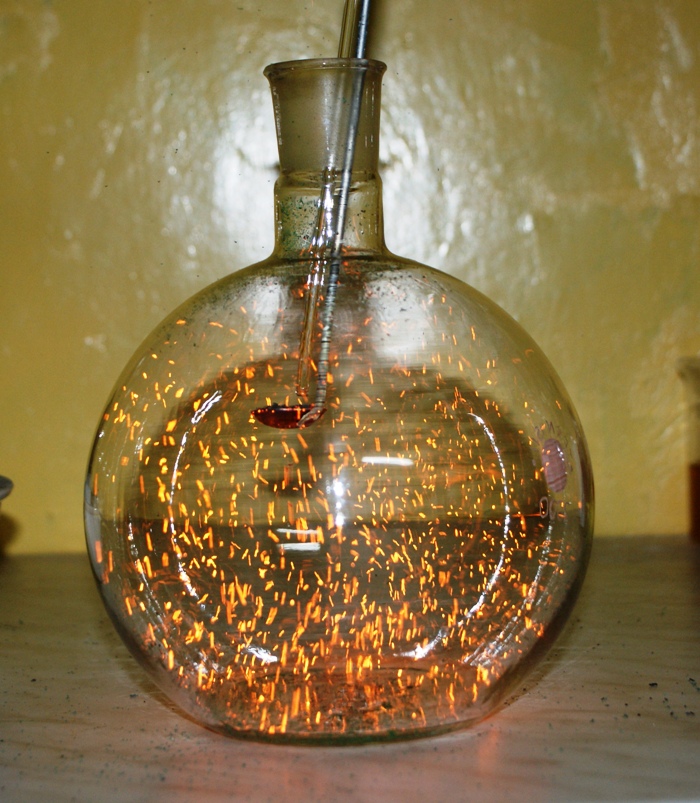
Rys. 14 Katalityczne utlenianie amoniaku - "świetliki".

Rys. 15 Katalityczne utlenianie amoniaku - "świetliki".
Efekt już mamy, nie da się go do końca pokazać na zdjęciu. Reakcja jest bardzo egzotermiczna - wydziela się podczas utleniania dużo ciepła a drobinki tlenku są bardzo lekkie, po zdmuchnięciu ich z łyżeczki tańczą po całej kolbie przypominając poruszające się w nocy świetliki.

Rys. 16 Katalityczne utlenianie amoniaku - "świetliki".
Część tych "świetlików" ucieka z kolby unoszona silnym prądem konwekcyjnym, na kolejnym zdjęciu będzie to bardzo dobrze widać, na łyżeczkę do spalań nasypałem słuszną ilość tlenku :) nie obyło się bez delikatnego oparzenia.

Rys. 17 Katalityczne utlenianie amoniaku - "świetliki".
Tam gdzie te iskierki opuszczają kolbę znajdowała się moja ręka, nie widać jej na zdjęciu bo znajdowała się nieco wyżej. Poczułem jednak "na własnej skórze" jak dużo ciepła w tej reakcji powstaje.

Rys. 18 Katalityczne utlenianie amoniaku - "świetliki".

Rys. 19 Katalityczne utlenianie amoniaku - "świetliki".
Jeszcze kilka sekund po dmuchnięciu "świetliki" poruszają się po całej kolbie.

Rys. 20 Katalityczne utlenianie amoniaku - "świetliki".

Rys. 21 Katalityczne utlenianie amoniaku - "świetliki".
Eksperyment jest tym bardziej efektowny, im w większym naczyniu jest przeprowadzany. Nasze "robaczki" Mają więcej miejsca na przemieszczanie się. Na Politechnice kolba miała na pewno ponad 10 litrów. Efekt piorunujący.
Nie jest też prostą kwestią zrobienie dobrego zdjęcia takiej reakcji, musiałem wykonać całkiem sporą ilość powtórek by odpowiednio dobrać wartości czasu naświetlania i przesłony. Zdjęcia chyba nie wyszły najgorzej :)






