Po stwierdzeniu przez Gay-Lussaca, że współczynniki rozszerzalności cieplnej różnych gazów i par są niemal jednakowe, zaczęto podejrzewać, iż każdy gaz mógłby w odpowiednich warunkach, podobnie jak para, przejść w stan ciekły.
W 1790r. Nartinus van Marum sprawdzał słuszność prawa Boyle'a - Mariotte'a dla amoniaku i przypadkiem skroplił ten gaz. Następnymi badaczami byli Jean-Francois Clouet (1751-1801) i Gaspard Monge (1746-1818), otrzymali oni ciekły dwutlenek siarki SO2. W 1822r. Charles Cagniard de la Tour (1777-1859) odkrył istnienie stanu krytycznego.
W 1823r. skraplaniem gazów zajął się Michael Faraday. Stosował bardzo prosta metodę: w jednym końcu grubościennej rurki w kształcie litery U podgrzewał substancję z której wydzielał się gaz, a w drugim końcu ten wydzielony gaz oziębiał. Wydzielanie gazu powodowało bardzo duży wzrost ciśnienia, w wyniku czego skraplał się on w końcu rurki umieszczonej w mieszaninie oziębiającej. Tą metodą Faraday skroplił m.in. chlor, siarkowodór, dwutlenek węgla. W 1845r. powrócił do tego zagadnienia i stosując metodę polegającą na odpompowywaniu pary zestalonego dwutlenku węgla skroplił większość pozostałych gazów poza sześcioma, nie udało mu się skroplić: wodoru, azotu, tlenu, tlenku węgla, tlenku azotu i metanu. Udało mu się uzyskać temperaturę -110 oC
Johann Augustus Natterer (1821-1900) próbował skroplić te gazy, nie udało mu się to jednak, mimo stosowania ciśnień do około 2800 atmosfer. Tych kilka "opornych" gazów zaczęto nawet uważać za gazy trwałe.
Przełomu w dziedzinie dokonał w 1869r. irlandzki fizyk Thomas Andrews. Badał on izotermy dwutlenku węgla przy różnych temperaturach i stwierdził, że gaz ten, który w zwykłej temperaturze daje się łatwo skraplać przy zastosowania wysokiego ciśnienia (ok. 50 atmosfer) - nie daje się już skroplić powyżej 31 oC. W ten sposób Andrew odkrył istnienie punktu krytycznego substancji. Powyżej temperatury krytycznej skroplenie gazu jest niemożliwe. Po ogłoszeniu wyników Andrewsa było już oczywiste, że warunkiem koniecznym do skroplenia gazu jest obniżenie jego temperatury poniżej temperatury krytycznej. Dalsze prace kontynuowano więc nie w celu zwiększania ciśnienia tylko obniżenia temperatury poniżej -110 oC.
Wielkim sukcesem fizyki było osiągnięcie temperatury poniżej punktu krytycznego nie skroplonych jeszcze gazów i wreszcie skroplenie ich. Dokonali tego w 1883r. znakomity fizyk Zygmunt Florenty Wróblewski i równie świetny chemik Karol Olszewski. Skroplili składniki powietrza, najpierw tlen a później azot.
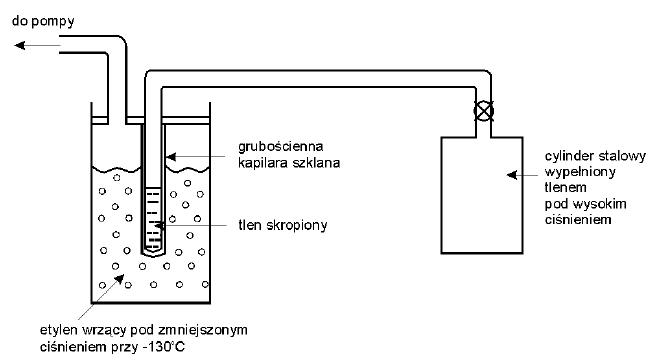
Rysunek powyżej przedstawia schemat aparatury użytej przez Wróblewskiego i Olszewskiego do skroplenia składników powietrza. W 1882 roku francuski fizyk L. P. Cailletet osiągnął temperaturę -105oC w kapilarze otoczonej wrzącym etylenem. Wróblewski i Olszewski przebudowali aparaturę Cailleteta. Znacznie obniżyli ciśnienie nad parującym etylenem (do 1/30 atm), co pozwoliło na uzyskanie temperatury -160 oC, a więc niższej od temperatury krytycznej tlenu (ok. -119 oC). Tym samym krakowscy naukowcy wygrali wyścig z czasem z Francuzami. Było wiele niedomówień w tej sprawie ale fakt pozostaje faktem, iż Wróblewski i Olszewski jako pierwsi widzieli tlen i azot w stanie ciekłym, z charakterystycznym dla tego stanu meniskiem. Sprawa skroplenia tzw. trwałych gazów miała olbrzymie znaczenie dla potwierdzenia budowanej wówczas teorii kinetyczno-molekularnej materii.
Postanowiłem i ja skroplić sobie trochę powietrza w mojej pracowni. Na szczęście nie musiałem już stosować skomplikowanej aparatury do obniżenia temperatury i stosować bardzo wysokich ciśnień. Zastosowałem skroplony już wcześniej azot o temperaturze -196 oC. Wydaje się to bez sensu skraplać ciekłym azotem powietrze, które przecież w dużej większości składa się z azotu, ale załóżmy że ciekły azot to po prostu zimna ciecz dzięki której skroplimy powietrze.

Niestety nie mam Naczynia Dewara, ale udało mi się przywieźć ciekły azot w szklanym termosie. Niewielką jego ilość przelewam do dwóch styropianowych kubków złożonych jeden w drugi.

Do skroplenia powietrza posłuży mi mała probówka z boczną rurką oraz mała pompka do nieznacznego zwiększenia ciśnienia gazu w probówce.

Wszystkie doświadczenia z ciekłym azotem bezwzględnie należy wykonywać w goglach ochronnych !!!. Zwłaszcza jeśli stosujemy naczynia szklane, które po gwałtownym ochłodzeniu mogą z dość dużą siłą rozprysnąć się i poranić twarz. Wrzące kropelki azotu też są niebezpieczne.

Probówkę zanurzyłem w ciekłym azocie i włączyłem pompkę sprężającą w probówce powietrze.
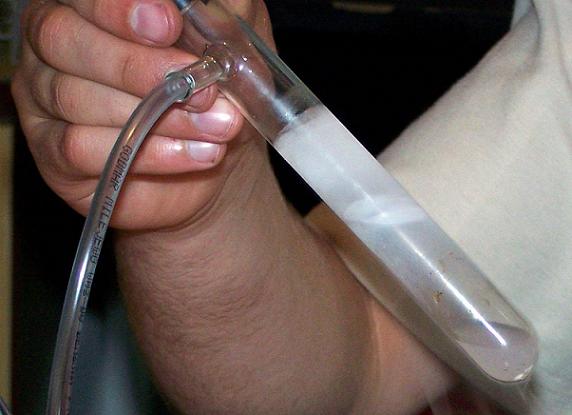
Po chwili na dnie probówki zebrała się niewielka ilość cieczy. Na początku myślałem, że w probówce powinien zebrać się ciekły tlen bo ma wyższą temperaturę skraplania od azotu. By to sprawdzić w cieczy zanurzyłem papierosa i podpaliłem, gdyby tam był ciekły tlen papieros spalił by się w ułamku sekundy jasnym płomieniem.

Udało się go zapalić ale szybko gasł, w probówce skropliło się powietrze.
Otrzymałem ciecz, która Karolowi Olszewskiemu i Zygmuntowi Wróblewskiemu przyniosła wielki sukces. Współpraca Olszewskiego i Wróblewskiego trwała krótko. Wkrótce się poróżnili i pracowali oddzielnie, rywalizując ze sobą w usiłowaniach skroplenia wodoru. W marcu 1888r. Wróblewski zmarł wskutek tragicznego wypadku, kiedy został dotkliwie poparzony strumieniem płonącej nafty z przewróconej lampy.
Olszewski w 1894r. skroplił jeszcze dopiero co odkryty argon, ale próby skroplenia wodoru nie powiodły się mu nigdy. Ten gaz skroplił dopiero w 1898r. James Dewar.












