Zauważyłem, że w opublikowanych w moim portalu eksperymentach brak jest ciekawych kolorów a przecież chemia to także kolory. Postanowiłem to zmienić i zrobić kilka kolorowych eksperymentów. Tym razem będziemy mieli znów do czynienia z ogniem ale spróbujemy zabarwić go dla odmiany na niebiesko."

 Podczas wykonywania prezentowanego eksperymentu należy stosować ochronę twarzy !!!
Podczas wykonywania prezentowanego eksperymentu należy stosować ochronę twarzy !!!
Istnieje realne niebezpieczeństwo utworzenia silnie wybuchowej mieszaniny wodoru z powietrzem, której eksplozja może rozerwać szkło.
W eksperymencie stosuje się także żrący kwas solny.
Eksperyment będzie bardzo prosty. W reakcji glinu w postaci zwitków cienkiej folii kuchennej z kwasem solnym wytworzymy gazowy wodór.

Do kolby trójszyjnej zanurzonej w większej zlewce z wodą nalewamy kwas solny i rozcieńczamy go wodą w proporcji 1:1 pamiętając o tym, że zawsze wlewamy kwas do wody a nigdy odwrotnie. Na zdjęciu widzimy także mniejszą kolbkę z zieloną cieczą. Jest to stężony roztwór chlorku miedzi, którego niewielką ilość dodajemy do wcześniej przygotowanego roztworu kwasu.

Teraz, gdy do kolby wrzucimy niewielką kulkę folii aluminiowej rozpoczyna się gwałtowna, silnie egzotermiczna reakcja z wydzieleniem gazowego wodoru. Temperatura cieczy gwałtownie wzrasta i dlatego kolbę należy chłodzić umieszczając ją w zimnej wodzie.
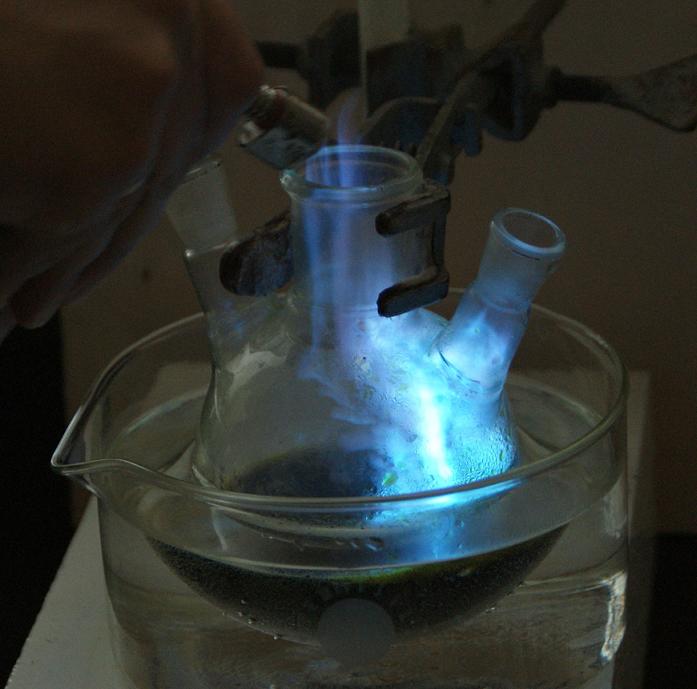
Zakładamy gogle ochronne i zapalamy wydzielający się w kolbie gaz. Ochrona twarzy jest w tym eksperymencie bardzo ważna bo wodór może utworzyć z powietrzem mieszaninę wybuchową i w momencie zapłonu może dojść do eksplozji, która rozerwie szkło.

Sam proces spalania wydzielającego się w reakcji wodoru nie był by niczym dziwnym, gdyby nie efektowny, niebieski kolor płomienia. Sam wodór spalał by się ledwo widocznym żółtawym płomieniem, więc skąd den piękny kolor?.

Pamiętamy, że przed wrzuceniem aluminium do kolby dodaliśmy do roztworu chlorek miedzi. W reakcji glinu z kwasem powstaje dość wysoka temperatura, ciecz zaczyna parować i unosi w postaci aerozolu cząsteczki wspomnianego chlorku wraz z wodorem.

Po zapaleniu wydzielających się gazów, odparowane cząsteczki chlorku miedzi ulegają rozkładowi w wysokiej temperaturze, która wzbudza atomy miedzi. Gdy atomy rekombinują emitują kwanty promieniowania o długości fali odpowiadającej naszemu efektownemu kolorowi.

W tytule napisałem "tańczący płomień" bo w trakcie spalania możemy zaobserwować także ciekawy efekt przemieszczania się małych płomyków po całej objętości kolby. Jest to spowodowane obecnością dużej ilości par kwasu i wody w rozgrzanej reakcją kolbie. Pary te przygaszają płomienie energicznie wydzielającego się wodoru, poza tym lekka kulka folii aluminiowej pływa po całej kolbie a płomienie wędrują za nią.














