 Destylacja jest procesem fizycznym, który przeciętnemu człowiekowi kojarzy się z niezbyt legalnym otrzymywaniem alkoholu etylowego, tzw. bimbru. Destylacja w tym przypadku jest sposobem oddzielenia czystego alkoholu, który powstał w procesie fermentacji cukrów przez drożdże. Do czego ten proces jeszcze może się przydać ?.
Destylacja jest procesem fizycznym, który przeciętnemu człowiekowi kojarzy się z niezbyt legalnym otrzymywaniem alkoholu etylowego, tzw. bimbru. Destylacja w tym przypadku jest sposobem oddzielenia czystego alkoholu, który powstał w procesie fermentacji cukrów przez drożdże. Do czego ten proces jeszcze może się przydać ?.
Destylacja jest procesem, którego celem jest rozdzielenie mieszaniny cieczy na jej składniki. Polega ona na odparowaniu cieczy, odebraniu i skropleniu powstałych par. Ciecz skroplona bogatsza w składnik lotniejszy nazywana jest destylatem, natomiast pozostałość nieodparowana nazywa się cieczą wyczerpaną (pogonem). Podstawę rozdziału stanowi tutaj różnica w lotności składników. Dlatego metodę tą stosuje się do oddzielenia alkoholu z roztworu pofermentacyjnego, którego głównym składnikiem jest woda o temperaturze wrzenia 100 st. C. Alkohol wrze w temperaturze 78 st. C więc paruje jako pierwszy.
Proces destylacji można wykorzystać nie tylko do rozdzielania mieszanin ale także do oczyszczania zanieczyszczonych substancji jak np. woda, w której rozpuszczone są minerały i zanieczyszczenia niepożądane w wielu zastosowaniach.
Rys. 1 Szklana aparatura do podwójnej destylacji wody.
Do tego celu służą najróżniejsze aparaty destylacyjne, jedno i wielostopniowe składające się w najprostszym wykonaniu z kotła wrzennego i chłodnicy w której skroplą się pary. Wraz z moim synem Wiktorem złożyliśmy troszkę bardziej skomplikowany aparat szklany do podwójnej destylacji wody na cele laboratoryjne i nie tylko. ...
Rys. 2 Wiktor przygotowuje aparat destylacyjny do pracy.
Woda jaką mamy w kranach, jaka płynie w rzekach i znajduje się w jeziorach i morzach nie jest czystą substancją, to wie chyba każdy. Wodę do picia nawet tę z kranu powinniśmy przynajmniej zagotować by zabić żyjące tam ewentualnie drobnoustroje, ale czy taka przegotowana woda nadaje się do pracy w laboratorium ?

Rys. 3 Woda wrząca w kolbie z grzałką.
Oczywiście ani do pracy w laboratorium ani do bardzo wielu zastosowań komercyjnych jak i przemysłowych zwyczajnie się nie nadaje. Nawet jak gotujemy ją w czajniku, po pewnym czasie zauważymy, że na dnie odłożyła się kamienista substancja. To właśnie część wytrąconych, rozpuszczonych w wodzie minerałów i o ile do picia są nawet w pewnych ilościach pożądane, to w wielu innych zastosowaniach niedopuszczalne. Na określenie zawartości rozpuszczonych w wodzie minerałów używamy określenia tzw. twardości wody. Jest to funkcja stężenia w wodzie kationów wapnia, magnezu, żelaza i manganu bo to głównie one w wodzie występują najczęściej i w największych ilościach. Jednak w wodzie może znajdować się o wiele więcej przeróżnych innych rozpuszczonych substancji dlatego by zbadać ją dokładniej stosuje się parametr przewodności elektrolitycznej, który znacznie więcej może nam powiedzieć o jakości wody.

Rys. 4 Woda wrząca w pierwszej kolbie naszego dwustopniowego destylatora.
Przewodność elektrolityczna, tzw. konduktancja jest miarą podatności wody na przepływ prądu elektrycznego. Naprawdę superczysta woda nie ma w sobie zbyt wielu jonów, jedynie trochę ze zdysocjowanych własnych cząsteczek ale jest to naprawdę bardzo mało. Prąd w takiej wodzie praktycznie nie będzie płynął i będzie miała ona bardzo niewielką konduktancję. Tak więc możemy ten parametr zastosować do badania stopnia wszelkiej mineralizacji wody. Jeśli jakaś sól w wodzie się rozpuści będzie źródłem jonów zdolnych przewodzić coraz większy prąd proporcjonalnie do zawartości tej soli. Do określania przewodności używa się jednostki Siemens [S/cm], jednak jest to bardzo duża wartość więc urządzenia pomiarowe - konduktometry skalowane są w mikro i milisiemensach/cm.
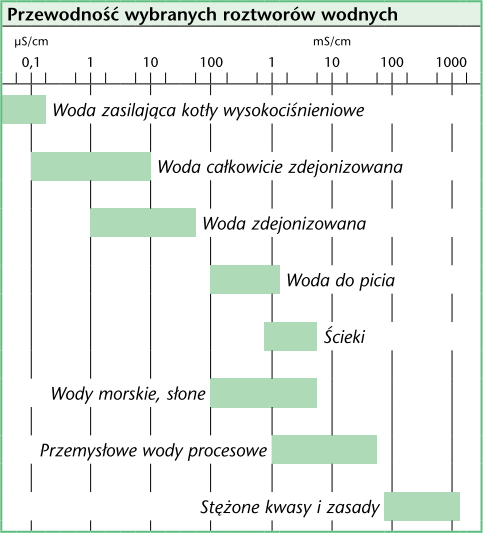
Rys. 5 Przewodność elektrolityczna wybranych roztworów wodnych. Źródło: "http://wtw.pl/katalog-plik/150"
Dzięki powyższemu zestawieniu mamy pogląd na różne rodzaje wody. Woda zasilająca wysokoprężne kotły parowe musi być naprawdę superczysta i pozbawiona wszelkich minerałów. Nawet minimalna ilość powodowała by odkładanie się ich na powierzchniach wymienników powodujących spadek sprawności lub korozję. Dalej mamy wodę zdejonizowaną oraz całkowicie zdejonizowaną oraz następnie przeciętną wodę do picia. W naszym eksperymencie poruszać się będziemy w tym zakresie.

Rys. 6 Schemat destylatora dwustopniowego.
Powyżej przedstawiłem na zdjęciu opis systemu szklanego do podwójnej destylacji wody. Mamy w nim dwie kolby z zamontowanymi fabrycznie grzałkami o mocy 1000 W w każdej. Zaczynając od prawej strony układu mamy tam odpływ wody ogrzanej z chłodnicy, która odbiera ciepło z par z obu wyparników, jest to jednocześnie źródło wody dla pierwszego stopnia destylacji, mamy tam kranik po przekręceniu którego uzupełniamy ciepłą wodą pierwszy wyparnik. Wrząca tam woda paruje a pary trafiają na jedną z wężownic w chłodnicy, gdzie ciepło z par odbierane jest przez płaszcz wodny - przepływa przez niego zimna woda z kranu. Schłodzone pary zamieniają się w ciecz i poprzez mały syfon przelewają się do drugiej kolby.

Rys. 7 Syfon przelewowy przez który destylat z pierwszego stopnia trafia do II etapu destylacji.
Po uruchomieniu obiegu chłodzenia należy kranikiem dopuszczającym napełnić pierwszą kolbę i tylko ją uruchomić, druga jest pusta. Dopiero gdy destylat z pierwszego etapu ją napełni, rozpoczynamy włączanie i ogrzewanie drugiej kolby. Gdy tam zacznie się proces wrzenia i parowania, pary trafią do drugiej wężownicy we wspomnianej wcześniej chłodnicy, ulegną skropleniu i opuszczą aparat.

Rys. 8 Pomiar temperatury i przewodności wody kranowej zasilającej aparat.
Za pomocą cyfrowego konduktometru dokonujemy pomiaru konduktancji wody kranowej. Odczytana wartość to 799 uS, gdy porównamy ją z zamieszczoną wcześniej tabelą odczytamy, że mieści się w zakresie wody do picia. By zastosować ją do celów laboratoryjnych musi zostać oczyszczona w naszym aparacie.

Rys. 9 Po napełnieniu drugiej kolby włączamy w niej grzałkę.
W międzyczasie druga kolba napełniła się destylatem z pierwszego etapu tak więc możemy i w niej uruchomić grzałkę i zacząć ją ponownie odparowywać. Na zdjęciu już widać, że woda w pierwszej kolbie zrobiła się lekko mętna. Wytrącany kamień nie za bardzo ma ochotę osadzać się na gładkim szkle dlatego będzie wytrącał się w postaci zawiesiny.

Rys. 10 Pracujące spirale grzejne w obu wyparnikach.

Rys. 11 Wrzenie rozpoczęło się także w drugiej kolbie.
Na powyższym zdjęciu od razu widać różnicę klarowności obu płynów. Największa część minerałów pozostanie w pierwszej kolbie.

Rys. 12 Wrząca woda w obu kolbach destylatora.
W odbieralniku zaczynają pojawiać się pierwsze krople dwukrotnie destylowanej wody, teraz należy wykonać jeszcze jedną czynność regulacyjną a mianowicie prędkość przepływu wody chłodniczej by nie tracić jej zbyt wile, ale też by następowało całkowite wykroplenie par. Przepływ najlepiej wyregulować tak by dolna część chłodnicy była możliwie całkowicie zimna,a z rurki wylotowej leciała tylko ciecz a nie pary.

Rys. 13 Pomiar temperatury wody chłodzącej na wylocie.
Po dokonaniu regulacji przepływu wody chłodzącej na optymalnym poziomie pomiędzy minimalnym zużyciem a maksymalną skutecznością chłodzenia, możemy już policzyć wydajność całego zestawu. Dokonałem też pomiaru temperatury wody opuszczającej płaszcz wodny chłodnicy. Wynosi ona 51,2 st. C. Temperatura destylatu jest podobna. W ciągu jednej godziny nasz zestaw destylacyjny wyprodukował 2,6 litra wody destylowanej i okupione to było 64 litrami wody chłodzącej i 2 kWh prądu elektrycznego. Nie jest to może zawrotna wydajność, ale woda jest dość dobrej jakości i do celów laboratoryjnych jak najbardziej się nadaje.

Rys. 14 Badanie organoleptyczne produktu.
W laboratorium generalnie nie wolno smakować żadnej z substancji, bo nawet te pozornie bezpieczne mogły zostać przypadkowo zanieczyszczone. Istnieje zbyt wysokie prawdopodobieństwo takiej sytuacji, jednak gdy w danej chwili, używając na pewno czystej aparatury i obserwują jak woda właśnie pojawia się w odbieralniku destylatora, można tę zasadę złamać. Wspólnie z synem spróbowaliśmy takiej wody i Wiktor stwierdził że coś jest nie tak bo jest niesmaczna. Rzeczywiście woda destylowana kompletnie pozbawiona jest smaku, bo to właśnie minerały go nadają. Wprowadzając ją do ust spłukujemy z kubków smakowych ślinę i receptory pozbawione jakichkolwiek bodźców, spotykają się z niezwyczajną sytuacją, którą mózg może interpretować jako zły smak.
Rys. 15 Badanie konduktometryczne wody destylowanej.
Teraz pora na bardziej niezależne i miarodajne pomiary za pomocą urządzenia konduktometrycznego. Zmierzona wartość przewodnictwa wynosi 14,79 uS/cm. Biorąc pod uwagę fakt, że nie płukałem aparatury i było to pierwsze uruchomienie, można mieć nadzieję, że wartość ta w dalszej pracy jeszcze się poprawi. Woda całkowicie zdemineralizowana, określana jako ultraczysta ma konduktancje na poziomie 0.055 uS/cm. Pochodzi ona od jonów wodorowych i wodorotlenowych z dysocjacji własnych cząsteczek. Jednak taka wartość jest bardzo trudna do osiągnięcia bo nawet po wlaniu do zwykłej szklanej zlewki pozyska ona sporą ilość jonów ze szkła a także z powietrza np. rozpuści się szybko trochę dwutlenku węgla i taka woda w otwartej zlewce szybko zyska konduktancję na poziomie 1 uS/cm.

Rys. 16 Pracujące wyparniki po oddestylowaniu ok 2 litrów wody.

Rys. 17 Pracujące w nocy kolby grzejne.

Rys. 18 Widok na wyłączone kolby po oddestylowaniu ok. 2 litrów wody.
Po wyłączeniu grzałek od razu widać różnicę w wyglądzie wody w pierwszej i drugiej kolbie. Praktycznie wszystkie minerały w makroskopowej skali zostały w pierwszej. Drugi etap usuwa związki w skali mikro, którym udało się przedostać razem z parami. W skali makroskopowej już ich widać nie będzie, dlatego woda w drugiej kolbie jest krystalicznie czysta.
Na zakończenie krótki film z pracy urządzenia.



















