Wykład z pokazami odbył się w Instytucie Fizyki Polskiej Akademii Nauk w Warszawie, al. Lotników 32/46. Prowadził: Dr Grzegorz Grabecki
Tematem wykładu będzie zademonstrowanie własności helu, zarówno w stanie gazowym jak i ciekłym. Przekonamy się, że zastosowania tej substancji są znacznie szersze niż powszechnie znane napełnianie baloników. Wykład odbył się w ramach X Festiwalu Nauki w Warszawie.Hel 2He4 (He, łac. helium) - pierwiastek chemiczny, z grupy gazów szlachetnych w układzie okresowym. Jest po wodorze drugim najbardziej rozpowszechnionym pierwiastkiem chemicznym we wszechświecie, jednak na Ziemi występuje wyłącznie w śladowych ilościach (4 × 10-7% w górnych warstwach).
Hel na Ziemi występuje głównie w atmosferze (5,2 × 10-4% obj. w powietrzu), pochodzi głównie z rozpadu jąder promieniotwórczych w naturalnych szeregach promieniotwórczych. W litosferze hel występuje również w niektórych złożach gazu ziemnego. W gazach występujących w Stanach Zjednoczonych dochodzi do 1%, w gazach występujących w Europie ilość ta jest bardzo mała. Praktycznie cały hel, który mógł pierwotne istnieć na Ziemi, nie mogąc związać się z żadnym innym pierwiastkiem, jako bardzo lekki opuścił atmosferę Ziemi.
Występuje w postaci dwóch izotopów trwałych - 3He i 4He oraz dwóch nietrwałych: 6He i 8He. Hel jest najmniej aktywnym pierwiastkiem chemicznym, z bardzo wysoką energią jonizacji. Nie udało się z nim uzyskać żadnego trwałego związku chemicznego. Nie ma żadnego znaczenia biologicznego.
 Pierwsza własność helu jaka została przedstawiona, jest chyba najbardziej znana nawet najmłodszym, chodzi oczywiście o napełnianie unoszących się w powietrzu baloników. Na zdjęciu obok studenci napełniają helem z butli balon. Ale dlaczego tak się dzieje ?, dlaczego balon wypełniony helem unosi się w powietrzu?. Odpowiedź jest prosta - ciężar właściwy helu wynosi: 0.17848 g/cm3 ... jest on blisko 7 razy lżejszy od powietrza i unosi się do góry jak kawałek styropianu wepchnięty do wody. Styropian ma bardzo dużą różnicę ciężaru właściwego w porównaniu z wodą i z dość dużą siłą prze do góry. W tym przypadku mówimy, że ma dużą wyporność.
Pierwsza własność helu jaka została przedstawiona, jest chyba najbardziej znana nawet najmłodszym, chodzi oczywiście o napełnianie unoszących się w powietrzu baloników. Na zdjęciu obok studenci napełniają helem z butli balon. Ale dlaczego tak się dzieje ?, dlaczego balon wypełniony helem unosi się w powietrzu?. Odpowiedź jest prosta - ciężar właściwy helu wynosi: 0.17848 g/cm3 ... jest on blisko 7 razy lżejszy od powietrza i unosi się do góry jak kawałek styropianu wepchnięty do wody. Styropian ma bardzo dużą różnicę ciężaru właściwego w porównaniu z wodą i z dość dużą siłą prze do góry. W tym przypadku mówimy, że ma dużą wyporność.
 Kolejną własność gazowego helu znają na pewno dociekliwi posiadacze baloników z helem, którzy dobrali się do ich zawartości i zaczęli ją wdychać. Na pewno zauważyli, że po kilku wdechach gazu ich głos upodabnia się do głosu Myszki Micki - jest piskliwy i wyjątkowo zabawny. W tym miejscu obalimy pewien mit, z którym już kilkakrotnie się spotkałem. Hel nie oddziałuje na organizm w żaden chemiczny sposób, nie wywołuje żadnych narkotycznych efektów a zmiana głosu związana jest jedynie z jego fizyczną własnością. Ta własność to prędkość rozchodzenia się dźwięku. Prędkość rozchodzenia się dźwięku w gazowym helu jest oczywiście konsekwencją poprzedniej własności (wg. wzoru na Vd prędkość rozchodzenia zależna jest od gęstości) i przedstawiona została na rysunku obok. Dla porównania dźwięk w powietrzu rozchodzi się z prędkością (zależną oczywiście od wielu czynników) 343 m/s. Gdy w wyniku kilku wdechów wypełnimy naszą krtań, gdzie drgają struny głosowe helem, w wyniku różnicy prędkości rozchodzenia się dźwięku, częstotliwość głosu zmienia się. Dzieje się tak dlatego że częstość drgań w komorze rezonansowej jaką jest nasz ośrodek mowy ściśle zależy od gęstości ośrodka, w którym te drgania zachodzą. Mówimy głosem o wyższej częstotliwości.
Kolejną własność gazowego helu znają na pewno dociekliwi posiadacze baloników z helem, którzy dobrali się do ich zawartości i zaczęli ją wdychać. Na pewno zauważyli, że po kilku wdechach gazu ich głos upodabnia się do głosu Myszki Micki - jest piskliwy i wyjątkowo zabawny. W tym miejscu obalimy pewien mit, z którym już kilkakrotnie się spotkałem. Hel nie oddziałuje na organizm w żaden chemiczny sposób, nie wywołuje żadnych narkotycznych efektów a zmiana głosu związana jest jedynie z jego fizyczną własnością. Ta własność to prędkość rozchodzenia się dźwięku. Prędkość rozchodzenia się dźwięku w gazowym helu jest oczywiście konsekwencją poprzedniej własności (wg. wzoru na Vd prędkość rozchodzenia zależna jest od gęstości) i przedstawiona została na rysunku obok. Dla porównania dźwięk w powietrzu rozchodzi się z prędkością (zależną oczywiście od wielu czynników) 343 m/s. Gdy w wyniku kilku wdechów wypełnimy naszą krtań, gdzie drgają struny głosowe helem, w wyniku różnicy prędkości rozchodzenia się dźwięku, częstotliwość głosu zmienia się. Dzieje się tak dlatego że częstość drgań w komorze rezonansowej jaką jest nasz ośrodek mowy ściśle zależy od gęstości ośrodka, w którym te drgania zachodzą. Mówimy głosem o wyższej częstotliwości.
 Fakt, że atomy helu są tak małe i lekkie sprawił, że hel znalazł zastosowanie w bardziej zaawansowanym urządzeniu, które można zobaczyć na zdjęciu obok. Jest to tester szczelności urządzeń próżniowych. Składa się on z pompy turbomolekularnej oraz spektrometru masowego ustawionego na wykrywanie atomów helu. Urządzenie podłącza się do testowanej aparatury, np. komory próżniowej i po włączeniu zaczyna wysysać z niego powietrze przepuszczając je jednocześnie przez spektrometr. Gdy zostanie osiągnięta wysoka próżnia obsługujący urządzenie odmuchuje gazowym helem komorę, której szczelność chce sprawdzić. Jeśli pojawi się jakaś nieszczelność hel przedostanie się do komory i w rezultacie zostanie zassany przez ciągle pracującą pompę do spektrometru, co w rezultacie da sygnał trafiający do układów elektronicznych. Nieszczelność może być sygnalizowana na wyświetlaczu bądź sygnałem dźwiękowym o zmieniającej się częstotliwości proporcjonalnie do wielkości nieszczelności.
Fakt, że atomy helu są tak małe i lekkie sprawił, że hel znalazł zastosowanie w bardziej zaawansowanym urządzeniu, które można zobaczyć na zdjęciu obok. Jest to tester szczelności urządzeń próżniowych. Składa się on z pompy turbomolekularnej oraz spektrometru masowego ustawionego na wykrywanie atomów helu. Urządzenie podłącza się do testowanej aparatury, np. komory próżniowej i po włączeniu zaczyna wysysać z niego powietrze przepuszczając je jednocześnie przez spektrometr. Gdy zostanie osiągnięta wysoka próżnia obsługujący urządzenie odmuchuje gazowym helem komorę, której szczelność chce sprawdzić. Jeśli pojawi się jakaś nieszczelność hel przedostanie się do komory i w rezultacie zostanie zassany przez ciągle pracującą pompę do spektrometru, co w rezultacie da sygnał trafiający do układów elektronicznych. Nieszczelność może być sygnalizowana na wyświetlaczu bądź sygnałem dźwiękowym o zmieniającej się częstotliwości proporcjonalnie do wielkości nieszczelności.
Hel ma bardzo słabe oddziaływania międzycząsteczkowe i w wielu wypadkach sprawia to poważne problemy np. podczas skraplania. Własność tę można jednak wykorzystać, dzięki niej hel jest bardzo zbliżony właściwościami do tzw. gazu doskonałego, czyli takiego, który spełnia prawa gazowe odkryte już w IX wieku np. stosunek ciśnienia do temperatury przy stałej objętości jest stały.
Skoro hel jest prawie doskonałym gazem można zastosować go np. do zmierzenia temperatury ciekłego azotu i w kolejnym eksperymencie taką temperaturę zmierzymy.


Będzie nam potrzebny ciekły azot, który przechowywany jest w tzw. naczyniu dewara czyli termosie wykonanym z metalu z zaworem bezpieczeństwa. Naczynie z ciekłym azotem przedstawia zdjęcie Nr 1, ciekły azot przelewany jest do mniejszego naczynia.
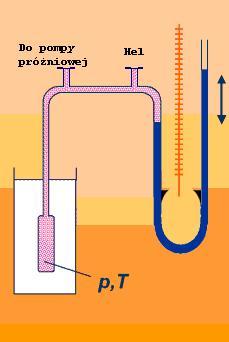 Rysunek po lewej przedstawia schemat naszego gazowego termometru. Oprócz ciekłego azotu, którego temperaturę chcemy zmierzyć potrzebna nam będzie pompa próżniowa, naczynie w którym schłodzimy hel oraz manometr, którym zmierzymy ciśnienie. Szklaną kolbę w której schłodzimy hel przedstawia zdjęcie Nr 2.
Rysunek po lewej przedstawia schemat naszego gazowego termometru. Oprócz ciekłego azotu, którego temperaturę chcemy zmierzyć potrzebna nam będzie pompa próżniowa, naczynie w którym schłodzimy hel oraz manometr, którym zmierzymy ciśnienie. Szklaną kolbę w której schłodzimy hel przedstawia zdjęcie Nr 2.
Pierwszą czynnością jaką wykonamy będzie połączenie wszystkich elementów jak na schemacie a następnie odpompowanie powietrza z układu za pomocą pompy próżniowej (zdjęcie Nr 3). Gdy z układu odpompujemy powietrze, z butli wprowadzimy do układu gazowy hel tak by jego ciśnienie osiągnęło wartość ciśnienia atmosferycznego. Wartość odczytana z naszego barometru wynosiła 610 Tr (Torów czyli mmHg). Gdy teraz schłodzimy naszą kolbę z helem wewnątrz zajdzie przemiana gazowa, tzw. przemiana izochoryczna. Zmieni się temperatura a wraz z nią ciśnienie helu, nie zmieni się tylko objętość bo nasz układ nie ma żadnych ruchomych elementów, które mogły by zareagować na zmianę ciśnienia (pomijamy gumowe węże, które skurczą się w sposób pomijalny). Skoro parametry naszego układu zmienią się musimy zapisać warunki początkowe i będzie to ciśnienie - 610 Tr oraz temperatura - 24 oC


Teraz możemy przystąpić do schładzania naczynia z helem, ciekły azot wlewamy do otwartego termosu i bańkę z helem połączoną do ciśnieniomierza wprowadzamy do termosu (zdjęcie Nr 4).

Temperatura helu będzie spadać i wraz z nią spadnie też ciśnienie co można obserwować na ciśnieniomierzu (zdjęcie Nr 3). Teraz wystarczy tylko zaczekać aż ciśnienie się ustabilizuje i zapisać jego wartość - P2 wynosi 160 Tr. Dalej znając definicję przemiany izochorycznej: stosunek ciśnienia do temperatury przy stałej objętości jest stały można już wyznaczyć temperaturę ciekłego azotu. Pozostały nam już tylko matematyczne wyliczenia.
Dane:
1) Temperatura przed schłodzeniem T1 wynosi 24 oC, musimy ją przeliczyć na wartość bezwzględną liczoną w Kelwinach: T1 = 273 + 24 = 297 K
2) Ciśnienie przed schłodzeniem P1 wynosi 610 Tr
3) Ciśnienie po schłodzeniu wynosi 160 Tr
Szukane:
1) Temperatura po schłodzeniu czyli temperatura ciekłego azotu wynosi: ?
Obliczenia:
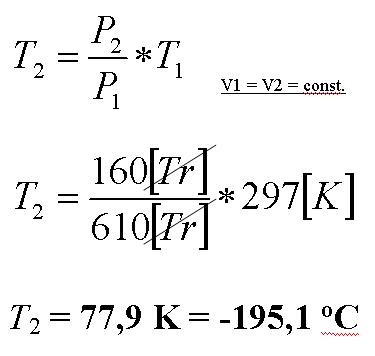 Pomiar udał się całkiem nieźle bo temperatura ciekłego azotu wynosi 77,3 K. Na błąd pomiaru wpływ miało wiele czynników np. niedokładność odpompowania powietrza, odkształcenia gumowych węży a tym samym zmiana objętości, niedokładność pomiaru ciśnienia i temperatury.
Pomiar udał się całkiem nieźle bo temperatura ciekłego azotu wynosi 77,3 K. Na błąd pomiaru wpływ miało wiele czynników np. niedokładność odpompowania powietrza, odkształcenia gumowych węży a tym samym zmiana objętości, niedokładność pomiaru ciśnienia i temperatury.
Zapraszam na kolejną stronę na której poznamy hel w najciekawszej postaci - hel ciekły.
Jak już pisałem wcześniej hel jest bardzo trudno skroplić ale udaje się to zrobić w bardzo niskiej temperaturze równej 4,18 K (- 269 oC). Do jego przechowywania, ze względu na niską temperaturę nie wystarczy zwykłe naczynie Dewara. Stosuje się naczynie z dwiema komorami oddzielającymi (zdjęcie obok). W pierwszej zewnętrznej komorze jest wysoka próżnia, a w kolejnej ciekły azot, który wstępnie schładza naczynie by różnica temperatur nie była tak duża. Dopiero w środkowym naczyniu przechowuje się ciekły hel. O tym jak otrzymuje się ciekły hel opowiem podczas wizyty w pracowni (ostatnia, 4 strona), w której pracuje tzw. skraplarka sublimacyjna. Teraz zobaczymy kilka ciekawych własności helu w stanie ciekłym i w stanie nadciekłym - ale po kolei.
Właściwości płynnego helu nie można od tak poznawać wlewając go po prostu do otwartego termosu jak w przypadku azotu - natychmiast by wyparował. Do badań stosuje się tzw. Kriostat, urządzenie bardzo podobne do naczynia z powyższego zdjęcia lecz umożliwiające przeprowadzenie badań.

Szklany kriostat przedstawia zdjęcie obok, jego schemat narysowany jest na tablicy na drugim planie. Składa się z zewnętrznej komory próżniowej, kolejne naczynie wypełnia się ciekłym azotem a po schłodzeniu przelewa się ciekły hel. Dodatkowo dla bezpieczeństwa cały kriostat otoczony jest rurą z pleksy, która osłoni badacza w razie pęknięcia któregoś z naczyń.
Do wnętrza kriostatu wprowadzone zostały dwa przewody na końcu których podłączona jest elektryczna grzałka. Gdy ciekły azot schłodzi wewnętrzne naczynie i zostanie ono wypełnione helem azot zaczął by zamarzać i całkowicie zasłonił by naczynie z helem. Dlatego po wprowadzeniu helu grzałka zostanie połączona z zasilaniem i posłuży do odparowania azotu. W ten sposób będzie możliwa obserwacja zachowania płynnego helu.
Na schemacie narysowane jest jeszcze jedno naczynie zanurzone w helu, w środku kriostatu ale będzie ono potrzebne w dalszej części eksperymentu.


Pierwszym etapem eksperymentu będzie połączenie zbiornika helu płynnego z kriostatem, służy do tego specjalna rura mieszkowa, która w rzeczywistości jest również termosem. Do momentu schłodzenia kriostatu przez azot koniec rury, który podłączony jest do zbiornika nie będzie miał kontaktu z płynnym helem, na razie będzie przepływał przez nią tylko hel gazowy.


Pierwsze z powyższych zdjęć przedstawia zalewanie ciekłym azotem naczynia schładzającego wstępnie kriostat. Na zdjęciu drugim widzimy dokładnie wszystkie warstwy kriostatu: zewnętrzną rurę z pleksy, komorę próżniową, w kolejnym naczyniu jest już trochę ciekłego azotu i widać przewody oraz samą grzałkę. Naczynie helowe jest jeszcze puste, widać tylko mały pojemnik o którym powiemy więcej w dalszej części.


Po schłodzeniu kriostatu azotem, można już pompować płynny hel, rurka, która wystaje dość wysoko ze zbiornika zostaje wsunięta tak, by zanurzyła się w płynnym helu. W zbiorniku zamknięty zostaje zawór odgazowujący i zbierające się ciśnienie parującego helu wypycha ciecz przez wsuniętą rurkę do kriostatu. Po zakończonym przepompowaniu górny wlot kriostatu trzeba rozmrozić by możliwym było wysunięcie rurki (zdjęcie 2).


Płynny hel już znajduje się w kriostacie, wrze podobnie jak ciekły azot ogrzewany już włączoną grzałką. Teraz w komorze, w której znajduje się hel obniżymy ciśnienie za pomocą pompy próżniowej. Ale zanim to zrobimy obniżymy w analogiczny sposób ciśnienie w probówce w której znajduje się zwykła woda. Przedstawia to powyższe zdjęcie Nr 2. po chwili widzimy że woda zaczyna wrzeć choć jej temperatura wcale się nie zwiększa, następnie woda zamarza a temperatura cały czas jest równa 24 oC. Dzieje się tak dlatego, że obniżenie ciśnienia powoduje obniżenie temperatury wrzenia wody.

A co się stanie z płynnym helem ?, czy również zamarznie ?. Zaczynamy obniżać ciśnienie nad cieczą i zobaczymy co się stanie. Po chwili zauważamy coś bardzo dziwnego - ciecz która do tej pory wrzała ze względu na zwykłą różnice temperatur nagle przestała wrzeć i o dziwo podczas dalszego obniżania ciśnienia nie zamarza jak woda. Dalej pozostaje w stanie płynnym. Jest spokojna i nic się z nią nie dzieje. Co się właściwie stało ?
Odpowiedź jest już trochę bardziej skomplikowana. Gdy obniżaliśmy ciśnienie temperatura ciekłego helu spadła z 4,18 K poniżej 2,18 K i w tym momencie wrzenie ustało. Zaprzestanie wrzenia tłumaczy się tym, że ciecz w takim stanie może przewodzić ciepło praktyczne bez oporu (wzrost przewodnictwa cieplnego następuje o około 106 razy. W tej chwili płynny hel, który jest praktycznie cieczą klasyczną przeszedł w tzw. stan nadciekły (Hel II).
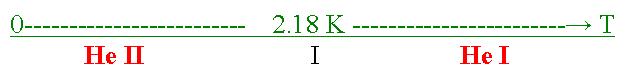
Część helu pozostała w swoim pierwotnym stanie, można powiedzieć że cała objętość cieczy zawiera składową nadciekłą.
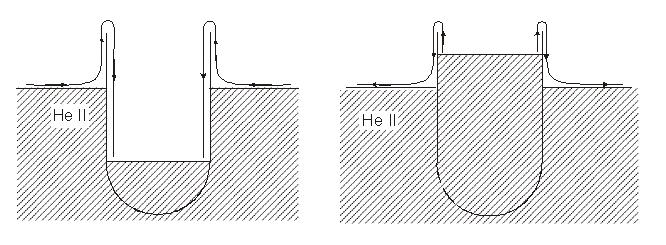
Hel w stanie nadciekłym ma kilka bardzo ciekawych własności, jedną z nich jest praktycznie zerowa lepkość. Hel w takim stanie może również wspinać się w postaci cienkiej błony po ściankach schłodzonego naczynia. Prędkość tego ruchu może być rzędu 30 cm / s . He I jest najpierw absorbowany na całej powierzchni chłodnego naczynia tworząc cieniutką błonę. Następnie błona działa prawie jak syfon, przez który ciecz przepływa prawie bez lepkości.
 Teraz w kolejnym eksperymencie wykorzystamy bańkę, o której wcześniej już wspominałem, jest to bańka na dnie której znajduje się bardzo drobny tlenek żelaza a nad nim węgiel drzewny.
Teraz w kolejnym eksperymencie wykorzystamy bańkę, o której wcześniej już wspominałem, jest to bańka na dnie której znajduje się bardzo drobny tlenek żelaza a nad nim węgiel drzewny.
Tlenek jest bardzo rozdrobniony, jego drobinki mają wielkości rzędu kilku nm. Gdy bańka znalazła się w nadciekłym helu wspina się on pomiędzy drobinkami tlenku aż dociera do węgla drzewnego. Teraz wystarczy włączyć źródło światła i kierować je na węgiel, który będzie się ogrzewał, nadciekły hel, który dotrze tam przez tlenek również się ogrzeje i wytryśnie przez kapilarę.
Efekt ten znany jest dość dobrze pod nazwą: Fontanna helowa i opisywany jest w wielu podręcznikach do fizyki.
Niestety nie udało mi się sfotografować samej fontanny, ciecz jest przezroczysta i aparat jej nie uchwycił. Mogę tylko zapewnić, że eksperyment się udał i fontanna wytryskiwała kilka minut. Na zdjęciu poniżej zafascynowani młodzi uczestnicy wykładu obserwują piękną fontannę.

Poniżej zamieszczam zdjęcie fontanny uzyskanej w innym laboratorium.

Pierwsze zdjęcie przedstawia kriostat, w którym uzyskano fontannę ze zdjęcia poniżej.

Na kolejnej stronie odwiedzimy pracownie, w której otrzymuje się ciekły hel.
 Pisałem wcześniej, że ciekły hel trudno jest otrzymać. To prawda jego słabe oddziaływania międzycząsteczkowe sprawiają poważne problemy, ale naukowcy te trudności potrafią przezwyciężyć i skroplić tak "oporny" gaz.
Pisałem wcześniej, że ciekły hel trudno jest otrzymać. To prawda jego słabe oddziaływania międzycząsteczkowe sprawiają poważne problemy, ale naukowcy te trudności potrafią przezwyciężyć i skroplić tak "oporny" gaz.
Zdjęcie przedstawia duży, metalowy kriostat w którym znajduje się tzw. skraplarka sublimacyjna ... C.D.N

















