Dzięki uprzejmości pana Dr Grzegrza Grabeckiego z Instytutu Fizyki Polskiej Akademii Nauk w Warszawie, al. Lotników 32/46, mogłem zobaczyć urządzenia, które pozwalają uzyskać bardzo niskie temperatury, oraz wykonać kilka efektownych eksperymentów w temperaturze ciekłego azotu.
Fizyka niskich temperatur jest naprawdę ciekawą i efektowną dziedziną. Materia w tych warunkach drastycznie zmienia swe właściwości zarówno makroskopowe, które możemy zobaczyć gołym okiem, jak i mikroskopowe - do których obserwacji potrzebny jest superczuły i skomplikowany sprzęt. W temperaturach ultra niskich, rzędu 10 - 100 mK zaczynają ujawniać się zjawiska kwantowe, które jeszcze nie zostały do końca poznane, a które bada się m.in. w Instytucie Fizyki PAN.

Na początek zaczniemy jednak od temperatur stosunkowo wysokich w porównaniu z tymi, o których napiszę później. Będzie to temperatura -196 oC - czyli temperatura ciekłego azotu (LN2 liquid nitrogen) Oczywiście, w odniesieniu do naszego codziennego życia taka temperatura jest naprawdę niska i by skutecznie przechowywać ciekły azot potrzebny jest pojemnik z bardzo dobrą izolacją cieplną. Takim pojemnikiem jest Naczynie Dewara - duży metalowy termos, którego ścianki składają się z dwóch warstw z pomiędzy których usunięto powietrze. Próżnia ma najmniejszy współczynnik przewodnictwa cieplnego i ciekły azot nie może pobierać ciepła z otoczenia dzięki czemu tempo parowania jest małe. Oczywiście w praktyce trochę ciepła zawsze przeniknie i pewna część azotu zawsze odparowuje, dlatego każde naczynie Dewara ma zawór bezpieczeństwa przez które ulatnia się nadmiar gazowego azotu. Z tego też względu np. w windzie, w której przewozi się zbiorniki z ciekłym azotem nie mogą znajdować się ludzie. Zdarzył się wypadek, w którym winda zatrzymała się awaryjnie na półpiętrze i uwięziła człowieka razem z naczyniem dewara pełnym LN2. Człowiek ten udusił się, gdyż parujący azot wkrótce wyparł tlen z windy.
Pierwszym eksperymentem jaki pokaże będzie zmiana właściwości mechanicznych potocznie wykorzystywanej gumy. W temperaturze pokojowej jest ona giętka i sprężysta. Ale gdy schłodzimy ją do temperatury LN2 ta własność bardzo się zmieni.

Przelewamy ciekły azot z Naczynia Dewara do bardziej poręcznego pojemnika.

Po wprowadzeniu do cieczy gumowej rurki rozpoczyna się natychmiastowe wrzenie. Podobnie woda zacznie wrzeć gdy wprowadzimy do niej rozgrzany pręt. Wszystko za sprawą bardzo dużej różnicy temperatur.

Jak widać giętka i sprężysta przed schłodzeniem rurka stała się twarda i bardzo krucha. Wystarczyło delikatne uderzenie by się pokruszyła. Z tego względu np. na Syberii nie wolno używać narzędzi metalowych w temperaturach poniżej -40 oC. Stają się kruche i mogą ulec uszkodzeniu.
Kolejny eksperyment, duża zmiana objętości pod wpływem bardzo niskiej temperatury.


 W probówce znajduje się stężony alkohol etylowy. Jego poziom zaznaczony jest na szkle niebieska kreską. Probówkę umieszczamy w styropianowym pojemniku i zalewamy ciekłym azotem. Efekt ochłodzenia jest bardzo wyraźny - objętość cieczy zmniejszyła się o prawie 10%. Właśnie tak działają termometry cieczowe - wraz ze spadkiem temperatury proporcjonalnie objętość cieczy się zmniejsza a jej menisk wyznacza temperaturę na podziałce.
W probówce znajduje się stężony alkohol etylowy. Jego poziom zaznaczony jest na szkle niebieska kreską. Probówkę umieszczamy w styropianowym pojemniku i zalewamy ciekłym azotem. Efekt ochłodzenia jest bardzo wyraźny - objętość cieczy zmniejszyła się o prawie 10%. Właśnie tak działają termometry cieczowe - wraz ze spadkiem temperatury proporcjonalnie objętość cieczy się zmniejsza a jej menisk wyznacza temperaturę na podziałce.
Termometr jest przykładem zastosowania tego zjawiska, ale są też niepożądane efekty zmiany objętości pod wpływem temperatury. Dobrym przykładem są szyny kolejowe, które zimą zmniejszają swą długość co może doprowadzić do ich pęknięcia. Podobny efekt zachodzi dla: mosty i inne wielkie konstrukcje stalowe ale w ich przypadku stosuje się tzw. przerwy dylatacyjne, w obszarze których konstrukcja może się poruszać.
Kolejne przykłady - zachowanie gazów w temperaturze ciekłego azotu. Na początek argon:


Zdjęcia powyżej przedstawiają balon wypełniony gazowym argonem. Balon połączony jest gumową rurką ze szklaną probówką, którą schłodzimy w ciekłym azocie. Jego temperatura skraplania wynosi 87 K, ciekły azot ma temperaturę 77 K więc jest niższa od tej w której skrapla się argon.


Argon znajdujący się w probówce przechodzi w fazę ciekłą, balon wywiera pewne ciśnienie więc na miejsce skroplonego gazu wpływa następna porcja, która również się skrapla i tak aż do całkowitego opróżnienia balonu.
 Po wyjęciu probówki z azotu zauważamy, że nie jest ona już pusta. Znajduje się w niej nieco cieczy - jest to ciekły argon, który wcześniej w fazie gazowej znajdował się w balonie. Jednak po wyjęciu probówki argon szybko paruje i z powrotem zaczyna wypełniać balon.
Po wyjęciu probówki z azotu zauważamy, że nie jest ona już pusta. Znajduje się w niej nieco cieczy - jest to ciekły argon, który wcześniej w fazie gazowej znajdował się w balonie. Jednak po wyjęciu probówki argon szybko paruje i z powrotem zaczyna wypełniać balon.
Teraz zwykły balon napełniony powietrzem:


Tlen, para wodna, argon i dwutlenek węgla zawarty w powietrzu, w balonie również się skraplają gdy balon zaczniemy schładzać.


Balon po chwili się skurczył a po wyjęciu z azotu szybko wraca do swojego pierwotnego kształtu.
 Dalej eksperyment podobny do poprzedniego. W długim metalowym pojemniku znajduje się ciekły azot, jego zewnętrzna metalowa powierzchnia schłodzona jest więc do temperatury -196 oC. W powietrzu atmosferycznym, w udziale ok. 20 % znajduje się tlen którego temperatura skraplania wynosi -183 oC
Dalej eksperyment podobny do poprzedniego. W długim metalowym pojemniku znajduje się ciekły azot, jego zewnętrzna metalowa powierzchnia schłodzona jest więc do temperatury -196 oC. W powietrzu atmosferycznym, w udziale ok. 20 % znajduje się tlen którego temperatura skraplania wynosi -183 oC
Metalowa rura ma temperaturę o 13 oC niższą od potrzebnej do skroplenia tlenu, więc na jej powierzchni pojawia się ciecz i spływa do metalowej kuwety na podłodze. Spływającą cieczą jest ciekły tlen o czym w prosty i efektowny sposób możemy się przekonać.
Do zebranej w kuwecie cieczy wystarczy przystawić tlące się łuczywko - łuczywko w czystym tlenie natychmiast rozpala się jasnym płomieniem.


Łuczywko można przystawić bezpośrednio do stróżki płynącego ciekłego tlenu, powierzchnia naczynia jest duża więc tlenu skrapla się naprawdę sporo.


W następnym doświadczeniu zaprezentuję zmianę własności sprężystych metalu - ołowiu.


Dzwon przedstawiony na zdjęciu wykonany jest z ołowiu - metal ten w temperaturze pokojowej jest miękki i plastyczny. Zupełnie nie nadaj się do budowy tego typu urządzeń. Osoba chcąca go użyć musiała by się naprawdę postarać by wydobyć z niego choć delikatny dźwięk (dźwięk jest głuchy). Energia uderzającej kulki jest pochłaniana przez miękki metal. Sytuacja zmieni się zupełnie po ochłodzeniu ołowiu w ciekłym azocie. Metal stanie się bardzo twardy i nie będzie się już wgniatał od uderzeń kulki pochłaniając w ten sposób energię. Dzwon wyda piękny metaliczny dźwięk. Metale w raz ze spadkiem temperatury stają się bardziej sprężyste.
Lewitacja magnetyczna.
Do kolejnego eksperymentu potrzebny będzie materiał, który w temperaturze ciekłego azotu zmieni swe właściwości i stanie się nadprzewodnikiem - będzie mógł przewodzić prąd elektryczny bez żadnego oporu elektrycznego. Jak stwierdzimy, że materiał (ceramika barowa YbaCuO) zmienił swe właściwości i stał się nadprzewodnikiem ? - w bardzo prosty sposób. Będziemy obserwować mały magnesik, który położymy na nadprzewodniku. Mają one bardzo ciekawą własność magnetyczną o której za chwilę.


W temperaturze pokojowej z magnesem nic się nie dzieje, bezwładnie spoczywa na czarnych pastylkach nadprzewodnika, które jeszcze nie wykazują żadnych nadprzewodzących właściwości. Po ochłodzeniu materiał staje się nadprzewodnikiem i ujawnia się zjawisko zwane Efektem Meissnera - polega ono na całkowitym wypychaniu pola magnetycznego z nadprzewodnika, odkryte zostało ono w 1933 roku przez Walthera Meissnera i Roberta Ochsenfelda. Przyczyną wypchnięcia jest pojawienie się w powierzchownej warstwie nadprzewodnika prądu elektrycznego o takim natężeniu, że wytworzone przez niego pole magnetyczne kompensuje wewnątrz nadprzewodnika pole magnetyczne. Związana z tym siła może utrzymać bryłkę magnesu. Tak lewitujący magnes może pozostawać w totalnym bezruchu lub wirować bez tarcia. Zjawisko nazywa się lewitacją magnetyczną.

Magnesik będzie lewitował tak długo aż cały LN2 wyparuje i temperatura nadprzewodnika zacznie wzrastać. Straci on swoje nadprzewodzące własności i magnes przestanie się unosić.


Obecnie bada sie intensywnie nadprzewodniki wysokotemperaturowe. Ostatecznym celem jest znalezienie lub synteza materiałów, które będą wykazywać właściwości nadprzewodzące w temperaturach pokojowych bądź zbliżonych. Odkrycie takiej substancji zrewolucjonizowało by współczesny świat wokół nas. Umożliwiało by poruszanie się pojazdom bez żadnego tarcia, co w dobie kryzysu energetycznego było by prawdziwą rewolucją. Dziś już co prawda poruszają się superszybkie pociągi na poduszkach magnetycznych ale wciąż chłodzenie magnesów nadprzewodzących pożera ogromne ilości energii.
Na razie to tyle eksperymentów niskotemperaturowych, na następnej stronie opowiem o temperaturach naprawdę superniskich, bliskich zera bezwzględnego.
Na drodze do zera bezwzględnego.
Na poprzednich stronach przedstawiłem kilka przykładów ciekawych zmian właściwości materii w dość niskich temperaturach. Zmiany te od razu widać gołym okiem. Ale co dzieje się z materią gdy temperaturę zaczniemy obniżać do zera bezwzględnego?. Co to takiego to zero bezwzględne ?. Jest to temperatura równa zero w termodynamicznej skali temperatur, czyli jest to temperatura, w której wszystkie elementy układu termodynamicznego uzyskują najniższą z możliwych energii. Temperatura ta odpowiada ok. -273,15 °C = 0 K
Temperatura zera bezwzględnego jest graniczną wartością temperatury do której możemy się ciągle zbliżać, ale jej osiągnięcie nie jest możliwe Wynika to z trzeciej zasady termodynamiki.
W roku 2003 zespół naukowców z Massachusetts Institute of Technology w Cambridge: A.E. Leanhardt, T.A. Pasquini, M. Saba, A. Schirotzek, Y. Shin, D. Kielpinski, D.E. Pritchard i W. Ketterle osiągnęli do tej pory najniższą temperaturę metodą chłodzenia laserowego - 450 nanokelwinów Wróćmy do pytania: co dzieje się z materią w tak niskich temperaturach?. Żeby to sprawdzić nie wystarczy już tylko wprawne oko naukowca. By zobaczyć zachowanie materii w superniskich temperaturach potrzebna jest bardzo droga i bardzo skomplikowana aparatura naukowa. A wytworzenie i utrzymanie tak niskich temperatur też nie jest zadaniem łatwym. Zdjęcie po lewej stronie przedstawia stalowy kriostat z wieloma ściankami izolacyjnymi, które mają za zadanie jak najbardziej ograniczyć przenikalność cieplną do obszaru niskiej temperatury.
Wróćmy do pytania: co dzieje się z materią w tak niskich temperaturach?. Żeby to sprawdzić nie wystarczy już tylko wprawne oko naukowca. By zobaczyć zachowanie materii w superniskich temperaturach potrzebna jest bardzo droga i bardzo skomplikowana aparatura naukowa. A wytworzenie i utrzymanie tak niskich temperatur też nie jest zadaniem łatwym. Zdjęcie po lewej stronie przedstawia stalowy kriostat z wieloma ściankami izolacyjnymi, które mają za zadanie jak najbardziej ograniczyć przenikalność cieplną do obszaru niskiej temperatury.
Cały zespół aparatury z kriostatem nazywa się schładzarką rozcieńczalnikową, która została zbudowana własnymi siłami w Instytucie Fizyki PAN. Dzięki niej możliwe jest osiągnięcie temperatury około 20 mK
W tak niskich temperaturach materia ujawnia zadziwiające własności magnetyczne i kwantowe i badaniami m.in. takich właśnie zjawisk zajmują się naukowcy w Instytucie.
Same eksperymenty i możliwości zastosowania potencjalnych osiągnięć w tej dziedzinie opiszę przy innej okazji a teraz zajmiemy się samą techniką osiągania tak rekordowo niskich temperatur.
Obserwując stopień skomplikowania aparatury możemy tylko domyślać się, że nie jest to zadanie łatwe i faktycznie tak jest.

Chłodziarka rozcieńczalnikowa pracuje w sposób ciągły, czynnikiem roboczym jest substancja, która nie zestala się aż do najniższych temperatur (pod cisnieniem atmosferycznym). Tą substancją jest mieszanina izotopu helu 3He i 4He. 3He występuje w przyrodzie w ilościach znikomo małych i dlatego otrzymuje się go sztucznie, jest przy tym bardzo drogi. Drugi izotop 4He - występuje w przyrodzie w dużych ilościach. Pozyskuje się go głównie z gazu ziemnego, gdzie jego stężenie może dochodzić nawet do 3 %.

Dlaczego te dwa izotopy wykorzystywane są do osiągania superniskich temperatur zilustrują dwa wykresy fazowe:
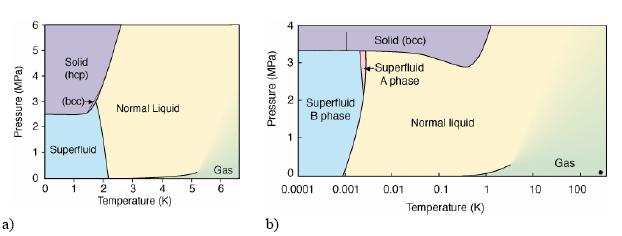
Na obu wykresach linie ciecz - para oraz ciecz - ciało stałe połączone są linią odgraniczającą od siebie dwie postaci helu, tzw. Hel I (zwykły, obdarzony lepkością i stosunkowo niewielką przewodnością cieplną) oraz Hel II (nadciekły, pozbawiony lepkości i charakteryzujący się bardzo dużą przewodnością cieplną). Bardzo ważne jest, że 4He przechodzi w stan nadciekłości w zakresie temperatur 2,17 - 1,77 K, natomiast 3He przy temperaturach rzędu kilku mK.

Bardzo ciekawe właściwości przejawia mieszanina obu wspomnianych izotopów.
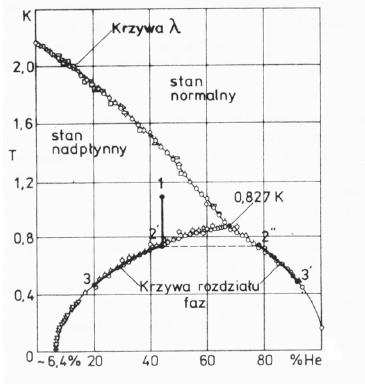 Na rysunku obok przedstawiłem wykres fazowy mieszaniny 3He - 4He przy ciśnieniu par nasyconych. Poniżej temperatury 0,873 K następuje spontaniczne rozdzielenie roztworu 3He - 4He na dwie fazy ciekłe oddzielone wyraźną granicą: fazę bogatą w 3He i ubogą w 3He (czyli bogatą w 4He). Faza bogata w 3He ma mniejszą gęstość i pływa po fazie ubogiej.
Na rysunku obok przedstawiłem wykres fazowy mieszaniny 3He - 4He przy ciśnieniu par nasyconych. Poniżej temperatury 0,873 K następuje spontaniczne rozdzielenie roztworu 3He - 4He na dwie fazy ciekłe oddzielone wyraźną granicą: fazę bogatą w 3He i ubogą w 3He (czyli bogatą w 4He). Faza bogata w 3He ma mniejszą gęstość i pływa po fazie ubogiej.
Na wykresie fazowym we współrzędnych temperatura - koncentracja (T-x) obszar rozdziału faz znajduje się pod krzywą "rozwarstwienia". Powyżej krzywej rozdziału roztwór znajduje się bądź w stanie normalnym bądź nadciekłym, zależnie od temperatury i koncentracji.
Przedstawiona własność roztworu izotopów helu ma kluczowe znaczenia dla działania chłodziarki rozcieńczalnikowej.
W stanie nadpłynnym lepkość i entropia fazy bogatej w 4He są prawie równe zeru. Ciecz ta staje się środowiskiem obojętnym dla rozcieńczanego w niej praktycznie czystego 3He. Stanowi ona pod względem cieplnym i hydrodynamicznym swoistą "próżnię" dla 3He, którego atomy nie oddziałują z nadciekłym 4He.
Proces rozcieńczania 3He w nadciekłej fazie bogatej w 4He można więc modelowo wyobrazić sobie jako parowanie 3He do próżni (Próżnią jest 4He). Podczas parowania ubytkowi masy 3He odpowiada spadek temperatury.
Moc chłodnicza tego procesu jest ekwiwalentna ciepłu przejścia fazowego: czysty 3He w słaby roztwór 3He. Rozcieńczaniu towarzyszy więc obniżanie temperatury roztworu ubogiego, natomiast jeśli proces prowadzony jest izotermicznie, to wytwarzana jest moc chłodnicza.
Schładzana przestrzeń jest stosunkowo niewielka ale umożliwia przeprowadzenie wielu badać kriogenicznych o których napewno jeszcze w tym dziale napiszę.
 Aktualnie w Instytucie Fizyki PAN trwa budowa nowoczesnego laboratorium z chłodziarką 3He (czynnikiem będzie tylko 3He), której kriostat i kilka rur roboczych już zainstalowano.
Aktualnie w Instytucie Fizyki PAN trwa budowa nowoczesnego laboratorium z chłodziarką 3He (czynnikiem będzie tylko 3He), której kriostat i kilka rur roboczych już zainstalowano.
Po zmontowaniu aparatury całość zostanie obudowana klatką Faradaya w celu wyeliminowania niepożądanego promieniowania elektromagnetycznego np. telefonów komórkowych. Na pewno do tematu nowej chłodziarki jeszcze wrócę.
Strona 5 z 5